CAPÍTULO A: EN CIENCIA REGULADORA DE PRODUCTOS PARA LA SALUD
ARTÍCULO 1. Aprobar la creación de la Maestría en Ciencia Reguladora de Productos para la Salud de la Facultad de Farmacia y Bioquímica.1
ARTÍCULO 2. Aprobar la Reglamentación General, el Plan de Estudios y los contenidos mínimos de las asignaturas de la Maestría a que se refiere el artículo 1º, y que forma parte del presente Capítulo. 2
PLAN DE ESTUDIOS3
I. INSERCIÓN INSTITUCIONAL DEL POSGRADO
Denominación del posgrado: Maestría en Ciencia Reguladora de Productos para la Salud.
Denominación del Título que otorga: Magister de la Universidad de Buenos Aires en Ciencia Reguladora de Productos para la Salud.
Unidad/es Académica/s de las que depende el posgrado: Facultad de Farmacia y Bioquímica.
Sede/s de desarrollo de las actividades académicas del posgrado: Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires.
Resolución/es de CD de la/s Unidad/es Académica/s de aprobación del Proyecto de posgrado.
Resolución (CD) RESCD-2021-360-E-UBA-DCT_FFYB
II.MODALIDAD
| Presencial | Distancia |
| X |
III. FUNDAMENTACION DEL POSGRADO
A) Antecedentes
a) Razones que determinan la necesidad de creación del proyecto de posgrado.
El concepto de Ciencia Reguladora no es nuevo, y ya había empezado a ser utilizado en la década del 70´y 80´por diversas agencias gubernamentales en diferentes partes del mundo. El uso de este término estuvo impulsado principalmente debido a la necesidad de definir un campo de estudio para ponderar y validar, con el menor grado de incertidumbre posible, la evidencia disponible para la toma de decisiones que las agencias gubernamentales deben adoptar dentro del marco de sus acciones regulatorias.
Para la Food and DrugsAdministration (FDA, EEUU), se entiende a la Ciencia Reguladora como la “ciencia que estudia el desarrollo de métodos, herramientas, estándares y criterios para evaluar la seguridad, eficacia, calidad y performance de los productos sanitarios” (AdvancingRegulatoryScienceforPublicHealth. Food and DrugAdministration. (FDA). EEUU, 2011.
En nuestro país, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) forma parte desde el año 2013 del Comité Ejecutivo de la Global CoalitionforRegulatoryScienceResearch (GCRSR). En este contexto, se celebra anualmente la Global Summit onRegulatoryScience (GSRS), que es una conferencia internacional para la discusión de tecnologías innovadoras y asociaciones con el fin de mejorar la aplicación de la ciencia básica en regulaciones dentro del contexto global.
La Global Summit onRegulatoryScience (GSRS) ofrece una oportunidad para que los científicos del gobierno, la industria y las comunidades de investigación académica evalúen objetivamente la utilidad de las tecnologías emergentes (como la nanotecnología, las ómicaspara la ciencia traslacional, la medicina personalizada, la seguridad de los productos médicos y la seguridad alimentaria) para abordar preguntas de investigación regulatoria y para discutir la mejor manera de aplicar estas tecnologías en el mundo real.
Con el propósito de involucrar a la comunidad global para abordar las necesidades de investigación y capacitación en ciencias reguladoras, se llevaron a cabo las siguientes cumbres:
- GSRS19: “Nanotechnologies and Nanoplastics” – Lake Maggiore, Italy
- GSRS18: “Risk/Benefit ofDietarySupplements and Herbal Medicine in the Era of Data Science” – Beijing, China
- GSRS17: “Emerging Technologies forDrug and Food Safety” – Brasilia, Brazil
- GSRS16: “Nanotechnology” – Bethesda, Maryland
- GSRS15: “RegulatoryBioinformatics” – Parma, Italy
- GSR14: “Genomics in thelandofregulatoryscience” – Montreal, Canada
- GSRS13: Nanotechnology – Arkansas, USA
- GSRS12: “ModernizingToxicology” – Hangzhou, China
A nivel nacional, en Septiembre de 2019 se celebró en la Ciudad de Buenos Aires el 1° Congreso Nacional de Ciencia Reguladora “Nuevos Caminos y Desafíos en Productos para la Salud”, organizado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) con el apoyo de la Academia Nacional de Farmacia y Bioquímica y del Ente Coordinador de Unidades Académicas de Farmacia y Bioquímica (ECUAFyB). La propuesta fue generar un espacio para el debate y la difusión de la Ciencia Reguladora y de acercamiento de los avances en materia regulatoria, propiciando el intercambio de experiencias en innovación vinculadas a productos para la salud.
Los ejes temáticos que se abordaron en este Congreso fueron:
- Desafíos Regulatorios: Acompañar los cambios para el bienestar de la población.
- Vigilancia: Fortalecer la red entre los actores públicos/privados y la comunidad.
- Innovación: Evaluar y fomentar el desarrollo dentro de un marco regulatorio adecuado.
- Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y la Comunidad: Generar información, participación, interacción y futuro.
- El Escenario de la Investigación Clínica: Impulsar la evidencia científica como base de las decisiones terapéuticas.
En cuanto a la bibliografía existente sobre Ciencia Reguladora, Sheila Jasanoff (profesora en la Escuela de Gobierno de la Universidad de Harvard), en su libro “TheFifth Branch. Scienceadvisors as policymakers” (1990), acuñó el término “Regulatoryscience” para referirse a ciertas particularidades del conocimiento producido con el fin de informar las decisiones políticas.
Inspirada en los estudios sociales de la ciencia y la tecnología, Jasanoff utilizó esta expresión para definir un campo de producción y uso de conocimientos que se diferenciaba de la Ciencia Académica. Mientras la Ciencia Académica tiene por objetivo la producción de “verdades” originales y significativas, el objetivo de la Ciencia Reguladora es producir evidencia científica útil para la toma de decisiones ligadas a la política y la regulación. Mientras en la Ciencia Académica, los actores principales son las universidades e institutos de investigación, en la Ciencia Reguladora más agencias gubernamentales y la industria ocupan un papel preponderante. A su vez, mientras el conocimiento académico es juzgado fundamentalmente por los pares científicos, el conocimiento regulatorio está sujeto a criterios legales de suficiencia y al escrutinio de los medios de comunicación, la justicia y el poder legislativo. El cuadro que se presenta a continuación resume las principales diferencias (Tabla 1).
Tabla 1: Diferencias entre Ciencia Académica y Ciencia Reguladora.
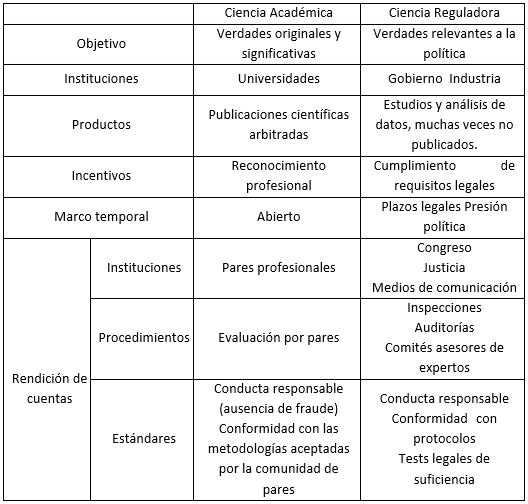
Fuente: Basado en Jasanoff (1990), p. 80.
El trabajo de Jasanoff (1990) se basa en el análisis del accionar de las agencias regulatorias en los Estados Unidos. Su foco original estuvo en la Agencia de Protección Ambiental (EPA), pero también se ha extendido a otras áreas como salud y alimentación (regulado por la FDA) y la salud ocupacional (regulado por OSHA). Esta autora señala que la Ciencia Reguladora comprende tanto la producción de conocimientos como su síntesis y uso predictivo. En primer lugar, alcanza las investigaciones diseñadas para cubrir vacíos en el conocimiento relevante para la regulación. En segundo lugar, la síntesis de conocimientos a través de reviews o meta-análisis juegan en ella un papel mucho más importante que en la Ciencia Académica. La revisión de la evidencia con herramientas nuevas disponibles puede ser fundamento de una nueva decisión regulatoria sin necesidad de producir nuevo conocimiento original. Finalmente, la Ciencia Reguladora se ocupa de la predicción, ya que tiene que lidiar con la determinación de cuán serio o significativo es un riesgo creado por una tecnología objeto de regulación.
De acuerdo con la definición de Alan Moghissi, presidente del InstituteforRegulatoryScience, una ONG dedicada a impulsar la Ciencia Reguladora, esta ciencia consiste en la aplicación única de la ciencia a los procesos de decisión social. En su visión, la Ciencia Reguladora involucra el uso de los datos e información disponible para mejorar y desarrollar regulaciones, leyes y sistemas judiciales efectivos. Cuando estos parámetros sociales o industriales se definen utilizando ideales o emociones antes que conocimiento científico, el público termina engañado (TheScientist, 2009).
La Ciencia Reguladora se ocupa de la generación del conocimiento necesario para avanzar en el desarrollo de un producto a través de estas etapas críticas. No es un conocimiento técnico sobre la regulación en sí o sobre los modos de lidiar con las agencias regulatorias desde la industria. Para esto último, suele utilizarse el término “asuntos regulatorios” [regulatoryaffairs]. La Ciencia Reguladora es un concepto más amplio que incluye componentes científicos, técnicos, jurídicos, sociales, económicos, etc. Es el conocimiento necesario para fundamentar sólidamente la toma de decisiones en estos campos.
En consecuencia, la Ciencia Reguladora no debe pensarse como un campo académico disciplinar o interdisciplinar. Se trata de un campo transdisciplinario híbrido en el que conviven científicos académicos e industriales, agencias regulatorias, la justicia, el congreso, etc. Siguiendo a Gibbons et al (1997) entendemos a la transdisciplina como un espacio en el que el conocimiento de diferentes áreas se nuclea en torno a la resolución de un problema. En el caso presente el problema está ligado a la regulación efectiva de los productos para la salud, pero en modo alguno puede pensarse como un problema académico exclusivamente. Se trata de un campo de conocimiento mixto en el que se desempeñan profesionales de diferentes formaciones e inserciones institucionales, tanto en el ámbito público como el privado.
En esta descripción de las características principales de la Ciencia Reguladora, se observan distintos aspectos esenciales de la misma: las agencias sanitarias tienen como meta disponer de la “mejor evidencia científica disponible” para la toma de decisiones en alguna de las etapas del ciclo de vida de los productos y esto lo deben realizar a partir de la información provista por diversos actores, ponderando dicha información, estimando posibles daños y evaluando los riesgos asociados a cada una de las opciones de las acciones a tomar.
Por lo tanto, la Ciencia Reguladora debe entenderse como un “campo de aplicación profesional” antes que como un campo disciplinar o interdisciplinario en sentido académico. Así, un posgrado en Ciencia Reguladora incluirá, desde distintas perspectivas científica, técnica y sanitaria, los diversos procesos involucrados en el descubrimiento, evaluación, producción y comercialización de productos sanitarios, como fluye y se recopila la información generada por todos los actores involucrados, cómo se identifican peligros y analizan riesgos asociados y, fundamentalmente, cómo se construye la evidencia que sustente, con la menor incertidumbre posible y en tiempo adecuado, las acciones regulatorias.
En esta propuesta de la regulación y fiscalización, el objeto de estudio de la Ciencia Reguladora son los productos sanitarios desde tres aspectos fundamentales: seguridad (que el producto sea inocuo en sí mismo, o, a lo sumo, el riesgo de un evento no deseado sea mínimo y esté justificado por los beneficios que brinda), eficacia (que el producto cumpla con los objetivos para el que fue diseñado –terapéutico, diagnóstico, nutricional, etc.-) y calidad (que el producto cumpla con estándares preestablecidos que aseguran su integridad y homogeneidad). Es menester resaltar que el cumplimiento de estos tres parámetros fundamentales es el objetivo fundamental de todas las agencias reguladoras de productos para la salud del mundo.
Para verificar la seguridad, eficacia y calidad de los productos sanitarios, las agencias reguladoras intervienen durante el ciclo de vida de los productos sanitarios (que comprenden diversas etapas, tales como el diseño/descubrimiento, evaluación, elaboración y comercialización de productos). Para ello, dichos organismos oficiales aplican un conjunto de conocimiento -o métodos, herramientas, estándares y criterios- en sus acciones de autorización, evaluación, registro, fiscalización, control, vigilancia y normalización.
Respecto a ello, observamos que, en muchos trabajos de investigación científica dentro del ámbito académico, se postulan hipótesis, se diseñan experimentos en los cuales se manipulan un número finito de variables, se recogen datos, los cuales se analizan bajo un nivel de incertidumbre preestablecido y se extraen conclusiones. En cambio, dentro del ámbito regulatorio, más precisamente en lo que se denomina “Ciencia Reguladora”, los datos se recogen a partir de múltiples actores que tienen un rol dentro del ciclo de vida de los productos sanitarios, tales como reguladores (datos generados por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) en sus acciones o por agencias pares), regulados (datos aportados por la industria regulada, la cual debe demostrar que sus productos son seguros, eficaces y de calidad), profesionales del ámbito de la salud (que prescriben y/o utilizan los productos sanitarios), ámbito académico, sociedades científicas, ciudadanos, instituciones o asociaciones de la comunidad, etc. Como se puede ver, dentro de la “Ciencia Reguladora” la fuente de datos es multidimensional/compleja y se nutre y enriquece por el aporte de los distintos actores sociales, dentro de los cuales en muchas ocasiones existen puntos de vista o intereses contrapuestos.
Por otro lado, los datos e información recogidos suelen tener un peso y relevancia particular en cada caso, y siempre se priorizará el cuidado y la integridad de la salud de las personas por sobre cualquier otro tipo de interés en juego. En muchas ocasiones, en Ciencia Reguladora, se suele destacar la relevancia social de sus conclusiones ya que éstas pueden afectar directamente la salud de la población.
Otro aspecto diferencial entre Ciencia Académica y Ciencia Reguladora es el factor tiempo. Dado que en Ciencia Académica el objetivo principal es la generación y generalización de conocimiento, el tiempo que ello demande puede ser variable y no una limitante. En cambio, en Ciencia Reguladora, orientada primariamente en “resolver problemas” el tiempo suele ser finito.
Asimismo, en Ciencia Académica, el nivel de incertidumbre suele estar prefijado de antemano y suele existir un valor aceptable; en Ciencia Reguladora, en cambio, se busca certeza predictiva, aunque en muchas ocasiones, ante escasez de datos y urgencia para la toma de decisiones, se pueden aceptar mayores niveles de incertidumbre (algunos autores postulan que el nivel de incertidumbre aceptable es directamente proporcional al posible daño asociado a la no toma de decisión).
Un último aspecto a resaltar, es que este posgrado no sólo está destinado exclusivamente a aquellos que se desempeñen en agencias reguladoras gubernamentales. En tanto, dentro de lo que se denomina “asuntos regulatorios” en el ámbito de la industria, se suele incluir cuáles son las normas o regulaciones que se deben cumplir en un campo dado, como por ejemplo registro de medicamentos o productos médicos, cosméticos, etcétera. A esta población profesional, oriunda de la industria, podría resultarle interesante este posgrado. Asimismo esta Maestría también piensa como destinatarios a quienes se desempeñan en el ámbito académico de la ciencia reguladora, en tanto, el conjunto de conocimientos que sustenta la regulación, explica la génesis, el sustento y el porqué de las regulaciones, permitiendo comprender el propósito de las mismas y, fundamentalmente, dando herramientas para su comprensión, mejora o reformulación en base a los nuevos escenarios producidos por la innovación. Por ello, el potencial de los interesados en este posgrado es amplio abarcando no sólo agentes reguladores / académicos sino también profesionales del ámbito amplio de la regulación.
Los principales ejes, de una oferta como la presente en Ciencia Reguladora de Productos para la Salud, tienen algunos antecedentes en universidades internacionales con algunos rasgos curriculares similares.
En la siguiente tabla se indican las principales ofertas académicas actuales en universidades internacionales sobre Ciencia Reguladora (Tabla 2):
Tabla 2: Ofertas académicas actuales en universidades internacionales sobre Ciencia Reguladora
| Universidad | País | Denominación del Título |
| Johns Hopkins University | EEUU | Master of Science in Biotechnology —concentration in Regulator y Affairs – Master ofScience in Bioscience Regulator y Affairs |
| University of Maryland Schoolof Pharmacy | EEUU | MS in Regulatory Science |
| University of Southern California | EEUU | MS in Regulatory Science |
| University of Pennsylvania Institutefor Translational Medicine and Therapeutics | EEUU | MS in Regulatory Science |
| North Eastern University | EEUU | Masters in Regulatory Affairs for Drugs, Biologics, and Medical Devices. |
| University of St. Thomas, Minnesota | EEUU | Master of Science degree in Regulatory Science |
| Georgetown University | EEUU | Master of Clinical and Translational Research Degree- Regulatory Science concentration programme |
| DUW Berlin University | Alemania | Clinical Research & Regulatory Affairs Certificate Programme |
| Rheinische FriedrichWilhelms-Universität Bonn | Alemania | Master in Drug Regulatory Affairs |
| Danube University Krems | Austria | EU Regulatory Affairs Certificate & Master of Science Program |
La mayoría de estas ofertas académicas focalizan en desarrollar herramientas, estándares y enfoques para evaluar la seguridad, eficacia y calidad de los productos regulados por Food and Drugs Administration (FDA). Asimismo, comprenden entre DIEZ y DOCE (10 y 12) cursos y otorgan entre TREINTA-CUARENTA Y OCHO (30-48) créditos.
En este sentido, al analizar el plan de estudios de estas universidades norteamericanas y europeas se observa que la gran mayoría incluyen espacios que abordan: una introducción a Ciencia Reguladora, productos farmacéuticos y alimentos, bioestadística, aspectos legales, aspectos económicos.
Por otro lado, se ha indagado acerca de estos antecedentes en nuestro país y se observó que existe un genuino vacío académico sobre esta temática. Se han hallado ofertas académicas que abordan algunos aspectos vinculados a lo científico, a las tecnologías, a la efectividad clínica pero no incluyen todas las dimensiones que convoca un objeto de estudio relacionado con la Ciencia Reguladora. Si bien se han analizado algunos diseños curriculares nacionales con temáticas afines a la Ciencia Reguladora, es constatable que no tienen por objeto académico el abordaje integral de la misma, algunos ejemplos de maestrías afines son:
- Maestría en Política y Gestión de la Ciencia y la Tecnología. Universidad de Buenos Aires. Facultad de Ciencias Económicas.
- Maestría en Efectividad Clínica. Universidad de Buenos Aires. Facultad de Medicina.
- Maestría en Ciencia Tecnología e Innovación. Universidad de San Andrés.
- Maestría en Gestión de la Ciencia Tecnología e Innovación. Universidad Nacional de General Sarmiento.
- Maestría en Ciencia, Tecnología y Sociedad. Universidad Nacional de Quilmes.
En este sentido y en base a diagnósticos desarrollados tanto con actores claves de este campo disciplinar como también en organismos nacionales como Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), se visualiza una creciente preocupación por este novedoso y potente objeto académico. A partir de las acciones de capacitación sistemáticas y encuestas realizadas por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y desde una lectura analítica del contexto científico-tecnológico actual se ha identificado la creciente necesidad de capacitación y actualización de posgrado en este campo disciplinar. En otras palabras, la conformación de una actividad de posgrado relacionada con problemáticas y esquemas de trabajo propios de la Ciencia Reguladora representa un genuino desafío.
Por otra parte, la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires hace más de una década ofrece una cantidad creciente de posgrados. Desde su Secretaría de Posgrado se destaca la relevancia de contribuir a mejorar las capacidades de los graduados de la Facultad de Farmacia y Bioquímica que permitan la generación de nuevos conocimientos científicos y tecnológicos para asistencia a la comunidad, la provisión de servicios, la industrialización y comercialización de productos bioquímicos y farmacéuticos. Esta casa de estudios desarrolla experiencias formativas en coordinación con instituciones profesionales y organizaciones del campo disciplinar como la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y con sedes académicas de prestigio internacional, con las que existen convenios e intercambio de docentes.
Asimismo, se cuenta con la riqueza y prestigio del plantel docente de la Facultad de Farmacia y Bioquímica y la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) cuyos integrantes aportan experiencias personales y profesionales, que promueven la integración de visiones disciplinares diversas en el marco de una oferta académica que se confeccionó con contenidos actualizados, con nuevos recursos, con la utilización efectiva de nuevas tecnologías de información y comunicación. En este sentido, se incluye la oferta de maestrías de la Facultad de Farmacia y Bioquímica:
- Maestría en Biotecnología.
- Maestría en Biología Molecular Médica
- Maestría Internacional en Ciencias Biomédicas (Argentino-Alemana) * Maestría en Salud Pública
- Maestría en Bromatología y Tecnología de la Industrialización de Alimentos
En este sentido, consideramos que una oferta académica como la presente que cuenta con los avales académicos, científicos y profesionales de estas instituciones – la Facultad de Farmacia y Bioquímica y la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT)–será una propuesta estratégica y fértil para la actualización de profesionales relacionados con la salud. Con el desarrollo de este posgrado entendemos que los participantes profesionales podrán adquirir competencias específicas vinculadas al “saber hacer”, en el campo de la Ciencia Reguladora y a su vez podrán contextualizar sus prácticas específicas en el escenario científico-tecnológico nacional, en el marco de las políticas sanitarias públicas implementadas por el Estado argentino y en su rol de funcionario público, incluyendo componentes formales y normativos.
B) JUSTIFICACIÓN
El proyecto se ajusta a los lineamientos del Reglamento de Maestrías de la Universidad de Buenos Aires establecido por lo dispuesto en el capítulo B CÓDIGO.UBA I-20
IV. OBJETIVOS DEL POSGRADO
La Maestría en Ciencia Reguladora de Productos para la Salud pretende conformar una masa crítica de profesionales altamente capacitados en el desarrollo de acciones y decisiones basadas en la Ciencia Reguladora de productos para la salud, a través de los siguientes objetivos:
- Difundir los principios y esquema de trabajo de la Ciencia Reguladora como paradigma actual en la función pública, particularmente en salud.
- Optimizar la evidencia disponible que permita la toma de mejores decisiones y asimismo seleccionar aquellas tecnologías efectivas y, en lo posible costo-efectivas, para fortalecer la transparencia de los procesos de registro y fiscalización de Productos para la Salud.
- Propender a la consolidación de la Ciencia Reguladora en ámbitos públicos, privados y sanitarios, en beneficio de la salud de la población y el mejoramiento de la calidad de vida de los ciudadanos.
V. PERFIL DEL EGRESADO
A partir del dominio del potencial explicativo de los principales enfoques y esquemas de trabajo de la Ciencia reguladora, el egresado de la Maestría en Ciencia Reguladora de Productos para la Salud podrá:
- Dirigir y coordinar acciones y agendas políticas en el marco de instituciones públicas tendientes a la elaboración, ejecución y evaluación de procesos de gestión en función de la Ciencia Reguladora de productos para la salud, atendiendo a las especificidades contextuales e institucionales.
- Realizar análisis de riesgo y estudios sobre aspectos inherentes a las lógicas de procesos de producción, divulgación y transferencia de conocimientos y evidencias.
- Dominar el potencial explicativo de los principales enfoques y esquemas de trabajo de la Ciencia Reguladora de productos para la salud.
- Liderar procesos de articulación de diversos actores y prácticas como también la utilización de diversos instrumentos, herramientas, recursos y tecnologías en vistas a lograr la construcción y optimización de espacios institucionales con la inclusión de la Ciencia Reguladora de productos para la salud.
VI.ORGANIZACIÓN DEL POSGRADO
a) Institucional:
La Maestría en Ciencia Reguladora de Productos para la Salud es un posgrado dependiente de la Facultad de Farmacia y Bioquímica y que contará con la participación de docentes a propuesta de las siguientes facultades (en orden alfabético):
- Facultad de Ciencias Económicas
- Facultad de Derecho
- Facultad de Filosofía y Letras
- Facultad de Medicina
La Maestría contará con UN (1) Comité Académico Ejecutivo, UNA (1) Comisión de Maestría, UN (1) Director, UN (1) Sub-director, hasta DOS (2) Coordinadores docentes, Directores de Tesis y docentes.
Serán autoridades de la Maestría los Directores y Sub-directores designados por el Consejo Directivo de la Facultad de Farmacia y Bioquímica.
COMITÉ ACADÉMICO EJECUTIVO
La Maestría contará con un Comité Académico Ejecutivo representado por el Decano adoficio de la Facultad de Farmacia y Bioquímica y el Administrador Nacional de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT). Serán sus funciones entender en cuestiones académicas y ejecutivas de la Maestría, como también tendrán injerencia en asistir y asesorar al Director en la toma de decisiones referentes al Posgrado.
COMISIÓN DE LA MAESTRÍA
La Comisión de la Maestría, estará constituida por CINCO (5) representantes titulares y sus respectivos suplentes: TRES (3) titulares y TRES (3) suplentes de las Facultad de Farmacia y Bioquímica y DOS (2) titulares y DOS (2) suplentes de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), designados por el Consejo Directivo de la Facultad de Farmacia y Bioquímica a propuesta del Decano. Deberán ser elegidos preferentemente entre profesores regulares u otros investigadores docentes de la – 15 –
Facultad de Farmacia y Bioquímica y de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) que hayan realizado una obra de investigación relevante avalada por sus trabajos y publicaciones, con título de doctor, magister o méritos equivalentes. Podrán también designarse especialistas que no pertenezcan al cuerpo docente de la Facultad, siempre que cuenten con similares antecedentes. Ejercerán sus funciones durante CUATRO (4) años y podrán ser reelectos.
La frecuencia y sede de reunión de la Comisión será establecida de común acuerdo entre sus miembros.
Las atribuciones de la Comisión de la Maestría son:
- Evaluar los antecedentes de los aspirantes.
- Proponer al Consejo Directivo:
a) La aceptación o rechazo, con dictamen fundado, de los aspirantes y el establecimiento de prerrequisitos cuando sea necesario.
b) La aprobación de los programas analíticos de las asignaturas.
c) La designación de los docentes de la maestría.
d) La designación de directores y codirectores, si correspondiera, de tesis y consejeros de estudios.
e) La designación de los integrantes de los jurados de tesis.
- Supervisar el cumplimiento de los planes de estudios y elaborar las propuestas de su modificación.
- Supervisar el cumplimiento del desarrollo de los planes de tesis.
- Determinar el número máximo de alumnos a cursar en la maestría en cada período.
- Reconocer y otorgar créditos a materias de posgrado que los maestrandos hayan cursado por fuera de esta maestría, que no excedan el CINCUENTA POR CIENTO (50%) de la carga horaria total de la maestría, con la aprobación del Consejo Directivo de la Facultad.
- Proponer al Consejo Directivo de la Facultad de Farmacia y Bioquímica:
a) La designación del Director, Sub-director y Coordinadores docentes.
b) La reducción o exención de los aranceles a aquellos alumnos que así Io soliciten y cuyos antecedentes así lo justifiquen.
c) Implementar las acciones que contribuyan al financiamiento de la Maestría, a través de convenios con instituciones nacionales o internacionales.
DIRECTOR
La Dirección estará representada por UN (1) profesor de la Facultad de Farmacia y Bioquímica elegido preferentemente entre profesores regulares u otros investigadores docentes, que hayan realizado una obra de investigación relevante avalada por sus trabajos y publicaciones, con título de doctor o magister o méritos equivalentes, o profesores eméritos o consultos. El Director tendrá a su cargo las tareas de organización, coordinación y gestión. Podrán proponerse como Directores de la Maestría a los profesores expertos en las disciplinas a desarrollar que acrediten, mediante la presentación de su curriculum vitae, competencia profesional y académica. El Director será designado por un período de CUATRO (4) años y podrá ser re-designado por otro período consecutivo o alternado.
SUB-DIRECTOR DE LA MAESTRÍA
La Maestría podrá tener un Sub-director que será UN (1) profesor de la Facultad de Farmacia y Bioquímica, designado de igual forma que el Director, elegido preferentemente entre profesores regulares u otros investigadores docentes, que hayan realizado una obra de investigación relevante avalada por sus trabajos y publicaciones, con título de doctor o magister o méritos equivalentes, o profesores eméritos o consultos. Podrán proponerse como Co-director a los profesores expertos en las disciplinas a desarrollar que acrediten, mediante la presentación de su curriculum vitae, competencia profesional y académica. Durarán CUATRO (4) años en sus funciones y podrán ser reelectos. Serán sus funciones asistir al Director y reemplazarlo en caso de ausencia.
Coordinadores docentes
La Maestría podrá tener hasta DOS (2) Coordinadores Docentes propuestos por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y designados por el Consejo Directivo de la Facultad de Farmacia y Bioquímica. Serán funciones de los Coordinadores Docentes asistir al Director y Sub-Director colaborando en la orientación y desarrollo de las actividades académicas y de gestión.
Docentes
Los docentes de la Maestría serán designados por el Consejo Directivo de la Facultad de Farmacia y Bioquímica a propuesta de la Comisión de Maestría. Podrán ser docentes de esta maestría profesores regulares u otros investigadores docentes que hayan realizado una obra de investigación relevante avalada por sus trabajos y publicaciones, con título de doctor o magister o méritos equivalentes, o profesores eméritos o consultos. Participarán en el cuerpo docente de la Maestría las Facultades de Farmacia y Bioquímica, Ciencias Económicas, Derecho, Filosofía y Letras y Medicina de la Universidad de Buenos Aires. Podrán también designarse especialistas que no pertenezcan al cuerpo docente de la Facultad, siempre que cuenten con similares antecedentes y personal especializado de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) que serán designados docentes invitados por el Consejo Directivo de la Facultad de Farmacia y Bioquímica.
Directores de Tesis
Podrán ser Directores de Tesis los profesores regulares, eméritos, consultos u honorarios de Universidad de Buenos Aires, profesores con roles similares de otras universidades y
antecedentes en dirección de proyectos y formación académica de recursos humanos, pertenezca o no a dichas universidades y con título equivalente o superior al que otorga el presente posgrado. Podrán además ser directores de Tesis aquellos docentes auxiliares con designación como Jefes de Trabajos Prácticos con título de Doctor, Magister o Especialista, que hayan demostrado trayectoria en la docencia, la formación de recursos humanos y la investigación científica.
Las funciones del Director de Tesis son las siguientes:
1) Supervisar el Plan de Tesis;
2) Presentar con su aprobación dicho Plan a la Comisión de la Maestría;
3) Orientar y supervisar el trabajo de investigación y la elaboración de la Tesis;
Los Directores de Tesis serán designados por el Consejo Directivo de la Facultad de Farmacia y Bioquímica a propuesta de la Comisión de Maestría, en relación con sus antecedentes en investigaciones en el área de la Maestría y sus actividades de docencia en posgrados afines. Con iguales criterios y procedimientos, la Comisión de Maestría también podrá proponer la designación de Codirectores de Tesis, cuando se considere necesario.
Convenios:
Se prevé la existencia de un convenio marco de cooperación académica y un convenio específico ente la Facultad de Farmacia y Bioquímica y la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para el desarrollo de las actividades del posgrado.
| Institución con la que se establecerá convenio | Objetivos esperados | Recursos humanos, físicos y/o financieros previstos | Principales resultados esperados |
| Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) | Favorecer la cooperación institucional con fines académicos | Centro de Documentación) y Facultad de Farmacia y Bioquímica (aulas y Biblioteca) Recursos económicos: Convenio entre la Facultad de Farmacia y Bioquímica y Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) | Diseño y desarrollo de la Maestría en Ciencia Reguladora de Productos para la Salud |
b) Académica:
b.1. Régimen de correlatividades
Sólo se exigirá correlatividades a los espacios finales de la Maestría en Ciencia Reguladora de Productos para la Salud. El Taller de Tesis tendrá como correlativas las asignaturas precedentes del primer año, a los fines de garantizar el tránsito por los espacios curriculares de base antes de efectuar el trabajo académico de egreso correspondiente.
b.2. Tipos de actividades académicas
En el marco de la Maestría en Ciencia Reguladora de Productos para la Salud, se prevén actividades formativas presenciales y actividades formativas con apoyo de Campus Virtual. En este sentido entonces, las principales actividades a emprender serán:
● Clases presenciales
Dentro de las clases presenciales se programarán:
Clases de exposición teórica y participación de los profesionales mediante la metodología exposición-discusión. Se prevén estrategias didácticas directas, que permitan socializar principales contenidos conceptuales y procedimentales.
Clases de trabajo práctico con metodología de análisis de casos y aprendizaje basado en problemas. En este sentido, se incluirán también tareas diseñadas con estrategias didácticas indirectas remarcando el descubrimiento en el aprendizaje, la exploración y producción por parte del estudiante profesional.
Clases prácticas de desarrollo de trabajos prácticos con consignas específicas destinadas a desarrollar habilidades de investigación acción y de resolución y toma de decisiones en la práctica profesional concreta. Mediante una metodología de indagación y aplicación práctica de conocimientos se propondrán actividades en las cuales se trabaje de forma individual y/o grupal para el diseño y desarrollo de tareas concretas. Asimismo, se propondrán instancias de trabajo didáctico con bases de datos científicas en las cuales se consignen sitios web, fuentes de revistas científicas y alguna otra documentación de importancia para el propio desempeño profesional y que asimismo permita ser resignificada desde la Ciencia Reguladora.
● Instancias complementarias virtuales
Las actividades complementarias serán dictadas a través de mediaciones no presenciales y se ajustará a la reglamentación vigente (Capítulo B CÓDIGO.UBA I-20). La carga horaria de trabajo virtual no superará el TREINTA por ciento (30%) de las horas totales para cada asignatura.En este sentido, las sesiones y actividades no presenciales-virtuales serán complementarias de los encuentros presenciales y pretenderán la construcción de conocimiento en forma grupal empleando estructuras de comunicación de colaboración. Asimismo, se prevé que las producciones sean compartidas en el grupo, siendo fundamental la participación activa de todos los miembros de forma cooperativa y abierta hacia el intercambio de ideas y enfoques a partir de formatos didácticos asincrónicos, como el foro, y sincrónicos, como el chat.
El docente brindará las normas, consignas y las condiciones de la actividad y realizará el seguimiento y la valoración de las distintas tareas que se llevarán a cabo. Se incluirán no sólo espacios de repositorios de materiales y sobre todo, apoyos multimedia que integrarán audio, imagen, texto y, si es posible, interactivas, orientadas por los distintos temas y contenidos así como actividades colaborativas mediante herramientas lúdicas y/o simulaciones que favorezcan el pensamiento crítico, el debate y la reflexión sobre la propia práctica laboral.
Se utilizarán las herramientas que brinda el entorno de la plataforma Moodle, entre otros: – Foros de intercambio, donde se producirán los diálogos entre los docentes con los alumnos y entre los alumnos entre sí, en base a preguntas disparadoras de los docentes, enriqueciendo los aprendizajes a través de las propias experiencias. Las conversaciones serán guiadas por los profesores quienes orientarán a los alumnos a la construcción colectiva del conocimiento.
- Actividades de producción, individuales o grupales, donde los alumnos trabajarán una consigna específica en base a recursos brindados por los docentes o búsquedas propias, que deberán subir a la plataforma. Como apoyo a estas actividades, se acompaña con un foro de consultas a los docentes.
- Cuestionarios, pueden ser de testeo de lectura o de evaluación. Los docentes pueden proponer cuestionarios de opciones múltiples, unir por pares, completar con respuestas cortas o elaboración de respuestas más complejas (de corrección de los docentes).
● Prácticas Profesionales Supervisadas
La formación en la práctica permite el desarrollo de habilidades profesionales y la construcción de estrategias personales y metodológicas para el trabajo en equipo, la interacción con profesionales de otros campos de conocimiento, la adquisición de actitudes de servicio y compromiso social, así como el modelado y vivencia de la ética profesional.
Proponemos un sistema donde se promueva la participación activa del maestrando. Un modelo de formación en la práctica desde una perspectiva integral implica la construcción de un escenario educativo natural, donde se desarrollan actividades prácticas, enfocado a la problemática y necesidades de las personas o grupos atendidos y sus contextos.
Las prácticas profesionales se realizarán en la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT). Este espacio curricular poseerá un “docente responsable” que será quien organice la práctica de los alumnos en las siguientes áreas de la Institución: medicamentos, alimentos, productos médicos, cosméticos y/o productos de uso doméstico.
b.3. Propuesta de Plan de Estudios
La Maestría en Ciencia Reguladora de Productos para la Salud es una maestría profesional (Capítulo B CÓDIGO.UBA I-20).
La opción por maestría profesional radica en entender que el tratamiento en este posgrado de este objeto académico de la Ciencia Reguladora se orienta a la consolidación de competencias propias de un campo de aplicación profesional, de las ciencias de la salud y afines en nuestro caso.
Este posgrado se vincula específicamente con el fortalecimiento y consolidación de competencias propias de las profesiones de la salud y se hallan estrechamente vinculadas en el correspondiente campo de aplicación profesional. A lo largo del proceso formativo de esta Maestría se profundiza en competencias vinculadas con marcos teóricos disciplinares y multidisciplinares que amplían y cualifican las capacidades de abordaje de la Ciencia Reguladora.
La Maestría en Ciencia Reguladora de Productos para la Salud tendrá una duración de DOS (2) años y estará conformada por el dictado de DIECISIETE (17) asignaturas y un Trabajo de Tesis. La duración total de la Maestría será de CINCUENTA Y SEIS (56) semanas, considerando VEINTIOCHO (28) semanas de calendario académico por año. Carga horaria semanal promedio: entre DOCE (12) y TRECE (13) horas. La Maestría tiene un total de NOVECIENTAS SESENTA (960) horas.
El Plan de Estudios propuesto está constituido por DIECISIETE (17) asignaturas cuatrimestrales y un Trabajo Final de Tesis. A continuación, se detalla el Plan de Estudios de la Maestría, no se prevén correlatividades, a excepción del Taller de Tesis, correlatividades asignaturas 1 a 10 y los sucesivos tramos del Taller de tesis.
Cuadro correspondiente al Plan de Estudios
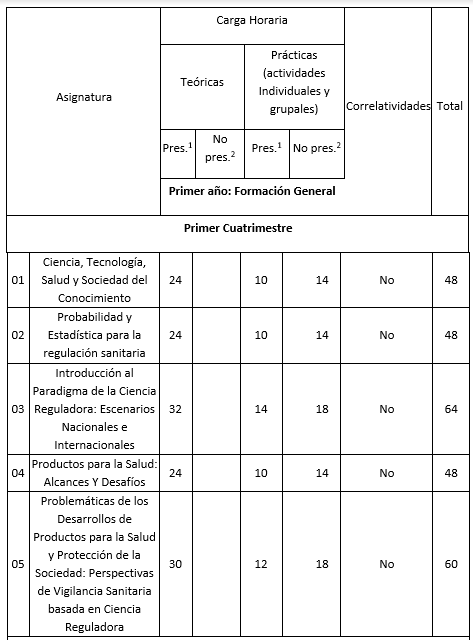
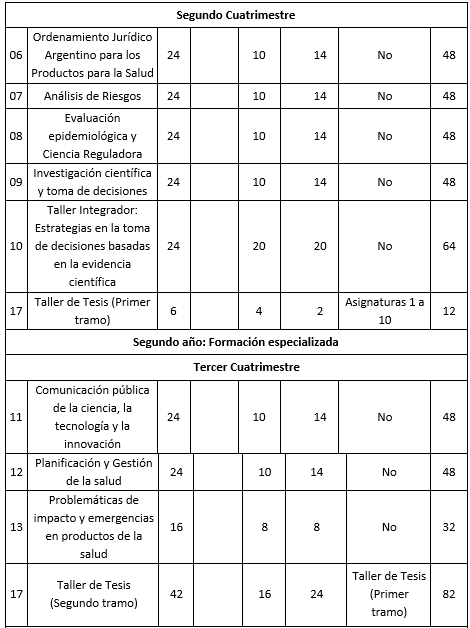
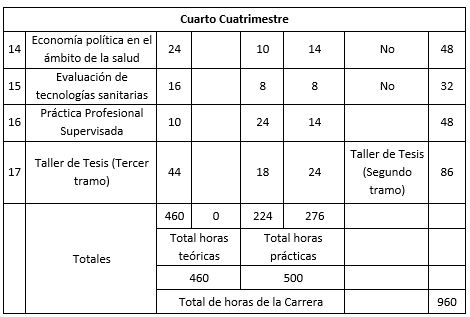
Referencias: 1 Presenciales, 2 No presenciales.
Carga horaria total de la Maestría: NOVECIENTAS SESENTA (960) horas.
El Plan de Estudios presenta un total de NOVECIENTAS SESENTA (960) horas totales, CUATROCIENTAS SESENTA (460) horas teóricas (todas presenciales) y QUINIENTAS (500) horas prácticas (DOSCIENTAS SETENTA Y SEIS (276) horas no presenciales).
Total de horas presenciales: SEISCIENTAS OCHENTA Y CUATRO (684) horas. (SETENTA y UNO PUNTO TRES por ciento (71,2%) del total de horas de la Maestría).
Total de horas no presenciales: DOSCIENTAS SETENTA Y SEIS (276) horas. (VEINTIOCHO PUNTO OCHO por ciento (28,8%) del total de horas de la Maestría).
b.4. Contenidos Mínimos
Primer año. 1er cuatrimestre
01- Ciencia, Tecnología, Salud y Sociedad del Conocimiento
Relación entre ciencia, tecnología y sociedad. Perspectivas políticas, económicas, éticas, filosóficas, axiológicas del quehacer científico. Concepto de sociedad del conocimiento. Ciencia y salud pública: revisión de principales conceptualizaciones. Determinantes y retos actuales en la relación ciencia- tecnología.
02- Probabilidad y Estadística para la regulación sanitaria
Aspectos generales de probabilidad y estadística. El caso del campo sanitario. Estadísticas y tendencias en los productos de la salud. Estadística descriptiva y estadística inferencial. Medidas de frecuencia, asociación e impacto. Modelos de regresión. Muestreos.
03- Introducción al Paradigma de la Ciencia Reguladora: Escenarios Nacionales e Internacionales
Definiciones de Ciencia Reguladora. Ciencia Académica y Reguladora. Ciencia y toma de decisiones. Contextos. Principios. Evaluación de variables en la toma de decisiones en salud. Situaciones actuales y desafíos en distintos contextos nacionales e internacionales respecto de la Ciencia Reguladora. El caso de la Coalición Global. Colaboraciones internacionales, acuerdos y relaciones. Apoyo a la innovación en el desarrollo de tecnologías sanitarias. Concepto del riesgo y la toma de decisiones en el marco de la Ciencia Reguladora. El desafío de la innovación.
04-Productos para la Salud: Alcances y desafíos
Definiciones y alcances de productos para la salud. Contextos, etapas, tiempos en el desarrollo de productos. El rol de ANMAT. Ciclo de vida de productos para la salud. Elaboración y control de productos. Regulaciones. Responsabilidades jurisdiccionales. Normativas. Desafíos. Experiencias. Las sustancias sujetas a control especial. Relevancia en salud pública.
05- Problemáticas de los Desarrollos de Productos para la Salud y Protección de la Sociedad: Perspectivas de Vigilancia Sanitaria basada en Ciencia Reguladora
Prioridades específicas de la planificación sanitaria en cuanto a las decisiones relacionadas con la producción de productos para la salud. Vacíos legales de diversas formas farmacéuticas. Formasfarmacéuticas que contienen opiáceos. Sistemas de vigilancia sanitaria, características de los reportes. Modalidades y actividades de prevención y control de enfermedades. Necesidades de información y posibles limitaciones para la recolección de datos.
Primer año. 2do cuatrimestre
06- Ordenamiento Jurídico Argentino para los Productos para la Salud
Orden jerárquico de las normas en materia de productos para la salud. La Constitución Nacional, leyes, resoluciones, disposiciones y circulares. La Autoridad Regulatoria Nacional. Antecedentes históricos y funciones: desde la creación del Departamento Nacional de – 24 –
Higiene hasta la ANMAT. La importancia de la sanción. Ley de Medicamentos. Las funciones y competencias de la ANMAT. Las autoridades sanitarias a nivel internacional. Normativa de bioética. Derechos de la propiedad industrial.
07- Análisis de Riesgos
Marco regulatorio. Estructura de los planes de gestión de riesgo (PGR). Herramientas, indicadores y fuentes de información. Perfil de seguridad, plan de minimización de riesgos, factores de riesgos, evaluación de la necesidad de las acciones de minimización de riesgos, evaluación de los PGR.
08- Evaluación epidemiológica y Ciencia Reguladora
Introducción a la Epidemiología. Su aporte al diagnóstico de los problemas de salud. Campos de aplicación. Causalidad y probabilidad en los problemas de salud. Métodos epidemiológicos aplicados a los productos para la salud. Tipos de estudios y medidas epidemiológicas. Abordaje epidemiológico del riesgo sanitario.
09- Investigación científica y toma de decisiones
La investigación científica, tecnologías, innovaciones en el campo sanitario. Aspectos, característicos, escenarios actuales y toma de decisiones. Investigación y desarrollo de productos para la salud. Regulaciones en la investigación en productos para la salud. Etapas de la investigación clínica y aspectos bioéticos.
10- Taller Integrador: Estrategias en la toma de decisiones basadas en la evidencia científica
Espacio integrador del esquema de trabajo en Ciencia Reguladora, con modalidad taller. La intención es consolidar los ejes que se vienen trabajando en las materias del ciclo y a modo taller con espacios prácticos vincular estos saberes con la toma de decisiones.
Segundo año. 3er. cuatrimestre
11- Comunicación pública de la ciencia, la tecnología y la innovación
La política pública. La comunicación estratégica. Comunicación desde una perspectiva de derechos. Dónde, qué y cómo comunicamos temas de salud. Ruidos de la comunicación. Planificación de la comunicación en salud: Definición de la estrategia. Los objetivos. Plan operativo. Monitoreo y evaluación. La comunicación como red. Comunicación en escenarios de crisis. Gestión. Relacionamiento con la prensa. La comunicación desde diferentes actores participantes o influenciadores. Actores internos. Convergencia de medios. El manejo de la imagen e identidad visual. Comunicación en el marco internacional. Comunicación publicitaria de productos para la salud.
12- Planificación y Gestión de la salud
Planificación de la gestión en servicios de salud. Procesos. Tipo de procesos. Metodología de trabajo por problemas. Estrategias. Resultados. Programación de acciones. Metodologías ágiles para la gestión. Gestión del cambio organizacional.
13- Problemáticas de impacto y emergencias en productos de la salud
Impacto y emergencias. Tipos de emergencia. Salud ambiental. Vigilancia y control de riesgos. Programas. Aspectos comunicacionales, jurídicos, económicos, vinculados a la gestión. Nuevos desafíos. Nuevas decisiones.
Segundo año. 4to. cuatrimestre
14- Economía política en el ámbito de la salud
Relación entre economía y ciencia. Economía y salud. Procesos de generación y difusión de la ciencia y tecnología examinando la perspectiva de la gestión económica y política: costos y presupuestos. Aspectos económicos y producción científica. Aspectos políticos. Políticas de medicamentos y de incorporación de tecnología. Medicamentos y productos de la salud y costos. Su impacto en la población. Los recursos humanos, su formación, distribución y condiciones de trabajo.
15- Evaluación de tecnologías sanitarias
Evaluación de Tecnologías Sanitarias (ETS): Definición ETS. Eficacia, efectividad, eficiencia. Importancia para la toma de decisiones basadas en la evidencia. ETS y ANMAT: Tipos de tecnologías sanitarias de incumbencia de ANMAT. Alcances de la ETS en ANMAT. ETS en otras agencias sanitarias. Pasos para el desarrollo de la ETS. Insumos/Fuentes bibliográficas. Metodología de trabajo. Resultados: análisis e implicancias. Informes de ETS. Ejemplo(s) del desarrollo de ETS. Contexto internacional: La ETS en el mundo. Principales agencias y organismos internacionales de ETS. Su rol en salud pública y relevancia de sus recomendaciones para la toma de decisiones. ETS e innovación. Rol de la ETS en la evaluación de nuevas tecnologías. Relevancia en la toma de decisiones para la aprobación de nuevas tecnologías sanitarias. Actualidad: datos más relevantes de ETS a nivel mundial. Implicancias. ETS y vigencia terapéutica. Rol de la ETS en la evaluación de la vigencia terapéutica de productos para la salud y en el ciclo de vida de los productos sanitarios.
16- Práctica Profesional Supervisada
Las clases teóricas comprenden los siguientes temas: ANMAT en el escenario sanitario: Antecedentes Históricos. Marco Normativo. Otras instituciones sanitarias en el mundo. Misión. Visión. Objetivos estratégicos. Estructura organizativa y autoridades: Organización de la ANMAT. Servicios y organigramas. Autoridades. Tareas e incumbencias en las áreas designadas para la práctica profesional: medicamentos, alimentos, productos médicos, cosméticos, y /o productos de uso doméstico.
La Práctica Profesional Supervisada consiste en una práctica en un sector de ANMAT, donde se desarrollen habilidades profesionales, se construyen estrategias metodológicas para el trabajo en equipo y la interacción con otros profesionales de otros campos de conocimiento y la vivencia de la práctica profesional. Para ello los alumnos eligen el lugar de ANMAT (un área de las anteriormente mencionadas) donde realizar la práctica. La organización de la práctica estará a cargo de un docente responsable y los maestrandos serán supervisados en cada área por un tutor, que puede ser el jefe del servicio o la persona que éste designe. El tutor supervisará y observará el desempeño del maestrando, la realización de las actividades y la elaboración de un informe. La dinámica será la realización de entrevistas, observaciones en escenarios reales de tareas propias del área, participación de ateneos a cargo de los tutores, análisis de documentos y normativas y encuentros con actividades.
17-Taller de Tesis
El diseño de investigación. La escritura académica. El diseño de investigación como documento académico. Definición de contexto de descubrimiento. El problema y la pregunta. Los objetivos. La búsqueda y análisis de antecedentes. El marco teórico. Andamiaje metodológico. El procesamiento de datos. Abordajes cuantitativos y cualitativos. Comunicación de las producciones académicas.
VII. ESTUDIANTES
1) Requisitos de admisión:
Los requisitos mínimos para solicitar la admisión a una Maestría son los que se detallan en el Capítulo B CÓDIGO.UBA I-20, o el que en un futuro lo reemplace, a saber:
a) ser graduado de la Universidad de Buenos Aires con título de grado en el área de la salud, en el área de las ciencias sociales como las ciencias económicas y el derecho, con orientación profesional y/o académica en el área de la salud, correspondiente a una carrera de CUATRO (4) años de duración como mínimo, o
b) ser graduado de otras Universidades Argentinas con título de grado en el área de la salud, en el área de las ciencias sociales como las ciencias económicas y el derecho, con orientación profesional y/o académica en el área de la salud, correspondiente a una carrera de CUATRO (4) años de duración como mínimo, o
c) ser graduado de universidades extranjeras que hayan completado, al menos, un plan de estudios de DOS MIL SEISCIENTAS (2.600) horas reloj o hasta una formación equivalente a master de nivel I, o
d) ser egresado de estudios de nivel superior no universitario de CUATRO (4) años de duración como mínimo y además completar los prerrequisitos que determine la Comisión de la Maestría, a fin de asegurar que su formación resulte compatible con las exigencias del posgrado al que aspira;
e) aquellas personas que cuenten con antecedentes de investigación o profesionales relevantes, aun cuando no cumplan con los requisitos reglamentarios citados, podrán ser admitidos excepcionalmente para ingresar a la Maestría con la recomendación de la Comisión de la Maestría y con la aprobación del Consejo Directivo de la Facultad de Farmacia y Bioquímica.
La Maestría podrá realizarse en un área diferente a la del título de grado. Asimismo, deberá presentar una Carta de Motivación, un Curriculum Vitae y acceder a una entrevista con la Comisión de Maestría.
2) Criterios de selección:
Las postulaciones serán evaluadas por la Comisión de Maestría quienes dejarán constancia del resultado del proceso en el sistema de postulación. Cada postulante deberá presentar la documentación que prevé este Reglamento, una Carta de Motivación y un Currículum Vitae. Asimismo, se dispondrá de una instancia de entrevista para ponderar los antecedentes y expectativas del postulante. Finalmente, se elaborará un Acta-informe que será comunicado al postulante.
3) Vacantes requeridas para el funcionamiento del posgrado:
Se prevé una cohorte de DIEZ (10) estudiantes como mínimo y CUARENTA (40) como máximo para el desarrollo de las actividades del posgrado.
4) Criterios de regularidad:
Inscripción al posgrado: Los aspirantes a la Maestría en Ciencia Reguladora de Productos para la Salud se inscribirán en la Facultad de Farmacia y Bioquímica.
La inscripción en la Maestría se realizará “on line” a través del sistema SIU-Guaraní disponible en la página web de la Facultad de Farmacia y Bioquímica (www.ffyb.uba.ar). En el momento de iniciar el trámite de inscripción los aspirantes deberán completar la Planilla de Inscripción adjuntando.
- Carta de motivación
- Fotocopia del certificado analítico de materias aprobadas.
- Fotocopia del título de grado legalizada, en caso de corresponder.
- Curriculum Vitae.
- Fotocopia de DOS (2) primeras páginas del DNI o pas
El postulante, una vez admitido a un posgrado, asume el carácter de alumno regular cuando se acredita el pago de la matrícula.
A partir de ese momento, el alumno se encuentra alcanzado por el Reglamento de la Maestría que se encuentre vigente y por las demás normas vigentes de la Facultad de Farmacia y Bioquímica, publicadas en la página web de la Facultad.
Inscripción a materias. Antes de iniciar cada período lectivo, el alumno deberá realizar su inscripción a materias a través del Sistema de Posgrado u otro medio que la Facultad de Farmacia y Bioquímica establezca.
De la regularidad y cursado
A los fines de aprobar cada asignatura del Plan de Estudios el alumno deberá satisfacer los siguientes requisitos:
1. Acreditar, como mínimo, el SETENTA Y CINCO por ciento (75%) de asistencia a las clases presenciales.
2. Cumplir con las exigencias de evaluación establecidas para las respectivas actividades en cada planificación aprobada por Consejo Directivo.
3. Ser calificado con una nota no menor a la que corresponde a “aprobado”, según lo dispuesto en la reglamentación vigente de la Universidad de Buenos Aires.
4. Cumplir con la totalidad de los requisitos académico-administrativos establecidos en cada planificación aprobaba por Consejo Directivo.
Duración de la regularidad. Aquellos maestrandos que hayan completado el pago del arancel de la maestría y no hubieran aprobado asignatura alguna del plan de estudios en un lapso de DOS (2) años, perderán su regularidad. La regularidad de las asignaturas cursadas será de DOS (2) años.
En caso que el estudiante no hubiere entregado el trabajo requerido para la aprobación de una asignatura dentro de los SESENTA (60) días posteriores a la finalización del dictado habrá reprobado el cursado. El Director podrá rever esta medida, con el acuerdo de la Comisión de Maestría, con carácter excepcional, en aquellos casos que a su juicio sean justificables.
El alumno que completara UN (1) año sin haber registrado ninguna actividad académica perderá su condición de regular y con ello la prioridad para inscribirse en los cursos dentro de los cupos establecidos. Al momento de solicitar su reincorporación, el alumno podrá pedir el reconocimiento de las asignaturas que haya cursado y/o aprobado con anterioridad, lo que será evaluado por el Director conjuntamente con la Comisión de Maestría.
El alumno que haya perdido su condición de alumno regular podrá recuperarla mediante la presentación de una solicitud de reincorporación o reinscripción dirigida al Director de la Maestría. La dirección elevará la solicitud a la Comisión de la Maestría y por su intermedio al Consejo Directivo para su tratamiento y consideración.
Promoción de las asignaturas y calificaciones. Los alumnos que hayan cumplido con los requisitos de asistencia y participación en el cursado,estarán en condiciones de rendir las evaluaciones o pruebas finales que los docentes a cargo establezcan. Particularmente, deberán:
a) estar habilitados administrativamente de acuerdo con las normas establecidas por la Facultad.
b) Completar la encuesta docente.
Promoción de la Maestría. El requisito final de graduación será la elaboración y aprobación de una Tesis de Maestría en un campo disciplinar o interdisciplinar, individual y escrito que evidencie el estudio crítico de información relevante respecto del tema o problema específico y el manejo conceptual y metodológico propio de la actividad de investigación. La tesis se desarrollará bajo la dirección de un Director de Tesis de Maestría, y si correspondiese en virtud de la temática, con un Codirector de Tesis.
Para presentar su Tesis, el alumno deberá tener aprobadas todas las materias del Plan de Estudios y su Proyecto de Tesis; asimismo, deberá haber efectuado la totalidad de los pagos correspondientes.
El maestrando presentará a la Comisión de la Maestría, CUATRO (4) ejemplares de la Tesis, un ejemplar quedará en la Biblioteca de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT). A propuesta de la Comisión de la Maestría, el Consejo Directivo de la Facultad designará TRES (3) miembros del Jurado que estará constituido por DOS (2) profesores de la Universidad de Buenos Aires y UN (1) profesional externo de otras universidades, destacados en el área de la Ciencia Reguladora. El Director no formará parte del Jurado. El Jurado evaluará la tesis en un plazo no mayor a UN (1) mes, contado a partir de su designación y de la recepción de la Tesis.
La Tesis de Maestría será defendida en acto oral y público ante un Jurado designado a tal efecto por la Dirección de la Maestría; los evaluadores calificarán el trabajo con dictamen fundado, según lo dispuesto en Capítulo B CÓDIGO.UBA I-20. La tesis podrá resultar: a) aprobado con dictamen fundado: la calificación podrá ser aprobado, bueno, distinguido o sobresaliente. En caso excepcional la calificación podrá ser sobresaliente con mención especial, b) devuelto: el jurado decidirá si el maestrando deberá modificarla o completarla y el plazo otorgado a tal fin, c) rechazado con dictamen fundado.
El alumno tendrá un plazo de hasta 2 (DOS) años, contados a partir de la aprobación de todas las asignaturas correspondientes al plan de estudios de la Maestría, para la entrega de la tesis. El alumno podrá solicitar mediante nota dirigida al Director de la Maestría, fundamentando debidamente los motivos de su pedido, una extensión del plazo mencionado, el que podrá ampliarse hasta en UN (1) año adicional. Quienes no hayan entregado la tesis en este tiempo perderán su condición de regular, debiendo realizar el proceso de reinscripción para concluir la Maestría.
Publicación o utilización de la Tesis. Si la tesis fuera aprobada, UN (1) ejemplar impreso y su correspondiente versión en soporte electrónico serán depositados en la Biblioteca de la Facultad de Farmacia y Bioquímica para su integración al Repositorio Digital Institucional de la Universidad de Buenos Aires, según lo dispuesto en las Res. Capítulo B CÓDIGO.UBA I-20. Al momento de su inscripción al posgrado, el alumno autoriza a la Facultad y la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) a disponer de las Tesis con fines académicos, pudiendo difundirlos por cualquier medio, haciendo mención de su autor y sin perjuicio del derecho del titular de hacerlo publicar o difundir en otros ámbitos. Las Tesis previstas se ajustan a la Ley Nº 11.723 de Propiedad intelectual. Para revocar esta autorización, el alumno deberá presentar una solicitud firmada y fundamentada.
Títulos y certificados. Quienes hayan completado la Maestría en Ciencia Reguladora de Productos para la Salud obtendrán un título académico cuyo correspondiente diploma será expedido por la Universidad de Buenos Aires, según lo establecido por lo dispuesto en Capítulo A CÓDIGO.UBA I-24. Para ello, deberán abonar los aranceles vigentes fijados por la Universidad y realizar el respectivo trámite.
VIII. INFRAESTRUCTURA Y EQUIPAMIENTO
La presente Maestría se desarrollará en las instalaciones de la Facultad de Farmacia y Bioquímica y en aulas de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) en sus distintas sedes, dispuestas para tal fin.
Los recursos físicos pertenecen a la Facultad interviniente, contando con infraestructura edilicia, equipamiento e instrumental adecuado a las necesidades. Las bibliotecas a disposición son las de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires y la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT).
IV. MECANISMOS DE AUTOEVALUACIÓN
La autoevaluación será efectuada a través de la Secretaría de Posgrado y la Subsecretaría de Autoevaluación y Acreditación de la Facultad de Farmacia y Bioquímica. Las autoevaluaciones se harán sobre la base de los informes del equipo de gestión de la Maestría y de los profesores de los distintos espacios curriculares. Asimismo, se realizarán procesos de encuestas de satisfacción a: estudiantes, graduados y docentes. Se sistematizará la información en el seno de la Comisión de Maestría: Facultad de Farmacia y Bioquímica y la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT). Los estudiantes deben mantener actualizada su ficha personal en la Secretaría de Posgrado donde constan sus datos personales, direcciones de contacto (e-mail, teléfonos), lugar y área de desempeño laboral. La Secretaría de Posgrado realizará un seguimiento de los graduados mediante la realización de TRES (3) encuestas a cada graduado de la Maestría en tres períodos distintos: al momento de la graduación, UN (1) año y a los CINCO (5) años del egreso.
[1] Resolución (CS) Nº 690/18
[2] Resolución (CS) Nº 690/18
[3] RESCS-2021-1016-UBA-REC
